每日经济新闻 2023-03-10 18:39:40
◎和铂医药的HBM1020注射液首度申报临床,据悉,HBM1020注射液是一款靶向B7H7的全球首创全人源单克隆抗体。目前在免疫肿瘤学领域,绝大多数经过临床验证的靶点都与B7家族有关。作为新近发现的B7家族成员之一,B7H7在多种难治肿瘤中表达,帮助肿瘤细胞逃避免疫系统的监测。
◎康宁杰瑞两款1类创新药再度申报临床,分别为重组人源化PDL1/CTLA-4双特异性单域抗体Fc融合蛋白注射液和重组人源化抗HER2双特异性抗体注射液。目前,这两款产品已有多项试验处于Ⅲ期临床阶段。
每经记者|陈浩 每经编辑|魏官红

《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。

根据药渡数据,2023年2月20日至2023年3月5日,国家药品监督管理局药品审评中心(CDE)共收到15家上市公司(含上市公司控股公司)提交的20个化学新药、治疗用生物制品新药申请(同一公司同一药物不同规格的申报,不分开计算)。

2023年2月20日至2023年3月5日期间,上市公司方面,迈威生物、辰欣药业、诺诚健华、东阳光药、香雪制药、阳光诺和、复宏汉霖、和铂医药、信立泰、翰森制药、君实生物、天境生物各提交1个临床申请,康宁杰瑞共提交2个临床申请,恒瑞医药共提交5个临床申请,基石药业提交1个生产申请。

1.和铂医药B7H7单抗中美双报临床
2月24日,CDE官网显示,和铂医药的HBM1020注射液首度申报临床。据悉,HBM1020注射液是一款由和铂医药Harbour Mice®H2L2转基因小鼠平台开发的靶向B7H7的全球首创全人源单克隆抗体,该抗体通过阻断免疫检查点靶点和配体的结合,增强抗肿瘤免疫。
和铂医药表示,HBM1020注射液因其创新的生物学机制,有望为难以从PD-(L)1抑制剂中获益的患者提供一种全新的抗肿瘤治疗方法。公司曾在1月12日发布公告称,HBM1020注射液已获得FDA的新药研究申请许可,将在美国启动相关临床试验。值得一提的是,HBM1020注射液是全球首个正式获批进入临床阶段的抗B7H7单克隆抗体。
行业洞察:
资料显示,B7H7是一种新型免疫调节分子,属于B7家族成员。B7家族在调节T细胞反应方面至关重要,在癌症免疫治疗方面受到业界的广泛关注。目前在免疫肿瘤学领域,绝大多数经过临床验证的靶点都与B7家族有关,包括PD-(L)1及CTLA-4。作为新近发现的B7家族成员之一,B7H7在多种难治肿瘤中表达,帮助肿瘤细胞逃避免疫系统的监测。
研究发现,B7H7在多种肿瘤组织中呈高表达,如乳腺癌(70.0%)、肺癌(66.7%)、甲状腺癌(66.7%),黑色素瘤(55.6%)、卵巢癌(50.0%)、胰腺癌(50.0%)、肝癌(40.0%)、膀胱癌(40.0%)、结肠癌(37.5%)、前列腺癌(33.3%)、肾癌(33.3%)和食道癌(20.0%),这提示B7H7有可能成为肿瘤免疫检查及治疗的新靶点。
公司点评:
和铂医药主攻肿瘤和免疫性疾病,目前暂无商业化产品获批。2019年至2021年期间累计亏损近5亿美元。2022年上半年,公司实现营收2763万美元,主要来源于公司与阿斯利康签订的关于HBM7022的授权协议,公司获得2500万美元的预付款和最高3.25亿美元的里程碑付款。
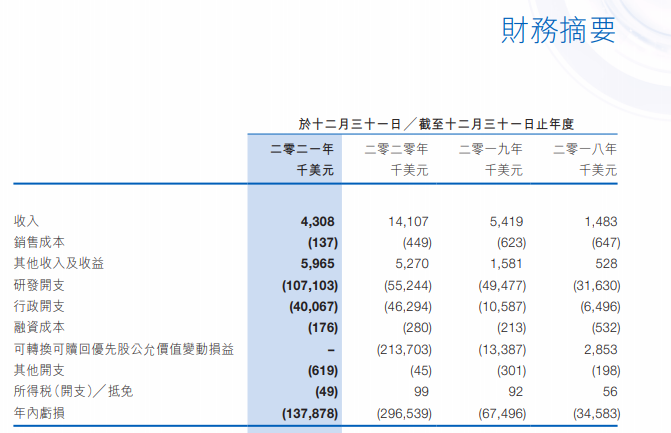
图片来源:公司财报截图
License-out是创新药企BD业务的重要组成部分,也是企业高效推动研发管线的重要途径。除HBM7022外,今年2月,和铂医药宣布,公司与Cullinan Oncology,Inc.签订授权及合作协议,授予该公司在美国(包括哥伦比亚特区和波多黎各)开发及商业化HBM7008的独家许可权。HBM7008是一款针对B7H4x4-1BB的双特异性抗体,根据协议,和铂医药将获得2500万美元预付款和最高6亿美元里程碑付款。
和铂医药的首款商业化产品距离面世已不远。3月6日,公司披露巴托利单抗(HBM9161)治疗全身型重症肌无力(gMG)的III期临床试验取得积极研究结果,该关键临床研究旨在确认巴托利单抗在治疗相关全身型重症肌无力患者时的疗效及安全性。
巴托利单抗是和铂医药从HanAll Biopharma引进的全球创新药,公司拥有在大中华地区进行开发、制造和商业化的权利。和铂医药表示,随着III期临床试验取得积极研究结果,标志着公司首款完成III期临床试验的产品正式进入商业化准备阶段。
《掘金创新药》研究员注意到,2022年以来,和铂医药陆续开展了包括License-out、技术授权等多个BD项目,多元化的BD项目为公司提供了成长动力,也促进了公司研发管线的进展。但另一方面,在新药研发“九死一生”的背景下,公司的多个BD项目或仍存变数。
2.两款双抗再度申报临床,康宁杰瑞商业化提速
2月28日,CDE官网显示,康宁杰瑞两款1类创新药再度申报临床,分别为重组人源化PDL1/CTLA-4双特异性单域抗体Fc融合蛋白注射液(KN046)和重组人源化抗HER2双特异性抗体注射液(KN026)。目前,这两款产品已有多项试验处于Ⅲ期临床阶段。
据悉,KN046在澳大利亚、美国和中国已开展覆盖非小细胞肺癌、胰腺癌、胸腺癌、肝癌、食管鳞癌、三阴乳腺癌等10余种肿瘤的20多项不同阶段临床试验。并且,2020年9月,FDA授予KN046用于治疗胸腺上皮肿瘤的孤儿药资格。
KN026是公司自主开发的一款抗HER2双特异性抗体,可以同时结合HER2的两个非重叠表位,阻断HER2信号。KN026于2018年分别在中国和美国获批进入临床阶段,目前正在两国开展多项不同阶段临床试验,适应症包括乳腺癌、胃癌/胃食管结合部癌等。
行业洞察:
双特异性抗体具有两个不同抗原结合位点的抗体,因此能够发挥比单抗更复杂的生物学机制,较单抗有显著优势。双抗是当前医药研发最炙手可热的领域之一,被誉为“下一代抗体药物”。东方财富证券研报显示,截至2022年9月,全球共有八款双特异性抗体获批上市,同时超50家国内企业布局双抗赛道。
2022年6月29日,康方生物的PD-1/CTLA-4双抗卡度尼利单抗(开坦尼)获批上市,用于治疗既往接受含铂化疗失败的复发或转移性宫颈癌患者,这也是首款获批上市的国产双抗。目前,我国已有3款双抗药物获批上市,艾美赛珠单抗(舒友立乐)和贝林妥欧单抗(倍利妥)分别在2018年和2020年在国内获得上市批准。
东方财富证券研报称,随着不同企业双抗研发平台逐渐成熟,多款药物进入临床阶段,国产双抗有望持续商业化;受益于药品临床价值、产品获批数量及适应症扩大,据沙利文统计,我国双抗市场规模在2030年将达647亿元,约为ADC药物市场空间的2倍。
公司点评:
2021年称得上是康宁杰瑞的商业化元年。2021年11月,国家药监局附条件批准公司的恩沃利单抗(KN035)上市,用于治疗不可切除或转移性MSI-H/dMMR晚期实体瘤,成为公司首款商业化产品,其也是全球首款皮下注射的PD-L1产品。此外,恩沃利单抗目前还在中国、美国和日本开展多个肿瘤适应症的临床研究。
但国内PD-(L)1赛道竞争愈发激烈,目前国内共有13款PD-(L)/1获批。白热化竞争下,PD-(L)/1药物价格战加剧,市场规模也低于预期。恩沃利单抗曾出现在2022年国家医保药品目录谈判初审名单中,但最终没能进入医保目录。
尽管已有首款商业化产品获批上市,但康宁杰瑞仍未到扭亏为盈的节点。2022年上半年,公司实现总收入7530万元,期内亏损1.47亿元。
相较于恩沃利单抗,康宁杰瑞对KN046和KN026两款双抗产品则抱有更多的期待。康宁杰瑞表示,预计将于2023年、2024年分别提交KN046、KN026的新药上市申请。此外,KN026联合KN046无化疗一线治疗HER2阳性局部进展不可切除或转移性胃/胃食管结合部癌的Ⅲ期关键性临床研究正在进行中。在2020年,KN026与KN046联合疗法获FDA授予孤儿药资格,用于治疗HER2-阳性或HER2-低表达胃癌及胃食管连接部癌。在上述两款双抗产品临床动作频频的情况下,康宁杰瑞的商业化进程有望提速。

封面图片来源:视觉中国-VCG41N923766082
如需转载请与《每日经济新闻》报社联系。
未经《每日经济新闻》报社授权,严禁转载或镜像,违者必究。
读者热线:4008890008
特别提醒:如果我们使用了您的图片,请作者与本站联系索取稿酬。如您不希望作品出现在本站,可联系我们要求撤下您的作品。
欢迎关注每日经济新闻APP
