每日经济新闻 2022-12-15 23:32:12
◎12月14日,瑞科生物发布公告,宣布其新佐剂重组蛋白新冠疫苗ReCOV的菲律宾II期序贯加强临床试验取得积极结果。研究结果显示,ReCOV序贯加强诱导的针对奥密克戎变异株BA.5和BA.2、原型株的真病毒中和抗体水平均显著优于mRNA疫苗组(差异有统计学意义)。
◎12月15日,瑞科生物召开线上沟通会,公司创始人、董事长兼总经理刘勇表示ReCOV在安全性、有效性和可及性方面具有综合优势,目前公司已向中国监管部门滚动提交产品上市申请,产品的商业化准备正在积极进行中。
每经记者|林姿辰 每经编辑|杨夏
随着防疫政策调整优化,国内防疫工作进入“下半场”,新冠疫苗作为预防新冠肺炎的主力武器,亟待升级换代。
12月14日,瑞科生物(HK02179,股价24.65港元,市值119.05亿港元)发布公告,宣布其新佐剂重组蛋白新冠疫苗ReCOV的菲律宾II期序贯加强临床试验取得积极结果。研究结果显示,ReCOV序贯加强诱导的针对奥密克戎变异株BA.5和BA.2、原型株的真病毒中和抗体水平均显著优于mRNA疫苗组(差异有统计学意义)。
12月15日,瑞科生物召开线上沟通会,公司创始人、董事长兼总经理刘勇表示ReCOV在安全性、有效性和可及性方面具有综合优势,目前公司已向中国监管部门滚动提交产品上市申请,产品的商业化准备正在积极进行中。
未来,如何让ReCOV在自费新冠疫苗市场上充分发挥优势,也是公司正在积极准备的内容。
瑞科生物公告显示,该II期研究共入组受试者600例,所有受试者均完成2剂灭活疫苗基础免疫,按照随机分组分别采用ReCOV疫苗或对照疫苗辉瑞mRNA疫苗(COMIRNATY)进行序贯加强接种,以比较ReCOV与mRNA疫苗加强免疫的免疫原性和安全性。
研究结果显示,在针对原型株、奥密克戎变异株BA.2和奥密克戎变异株BA.5的临床研究中,ReCOV疫苗的中和抗体水平均明显优于mRNA疫苗;在针对近期广泛流行于北京地区的BA.5变异株的研究中,研究接种14天时,ReCOV组、mRNA疫苗组针对奥密克戎变异株BA.5中和抗体的阳转率(SCR)分别为92.1%及88.4%,中和抗体GMT分别为4387.4及3100.6,ReCOV组均显著高于mRNA疫苗组。
此外,ReCOV组诱导的中和抗体较基线升高22.47倍,明显高于mRNA疫苗(15.89倍)。ReCOV组针对奥密克戎变异株BA.5的中和抗体较原型株仅下降1.77倍,显示出交叉中和作用。
同时,研究还证明ReCOV的总体安全性良好。截至数据分析日,接种ReCOV的受试者均未报告SAE(严重不良事件)或导致提前退出研究的TEAE(治疗相关的不良事件),也未报告有临床意义的生命体征或临床实验室检查异常。
“从产品的稳定性上来讲,ReCOV在室温下存放至少6个月,在2-8度的情况下至少存放24个月,都可以高度稳定,仍然符合质量标准。所以在有效性、安全性、可及性上,ReCOV都有独特优势。”
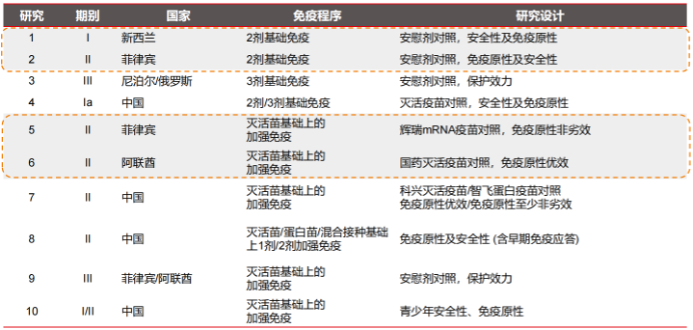
瑞科生物首席医学官张建慧表示,目前公司已对ReCOV制定了至少10项境内外临床开发计划,部分已经完成或者正在结尾。其中,4项临床试验针对基础免疫展开,6项临床试验针对加强免疫展开。
值得注意的是,公司在阿联酋开展的灭活疫苗基础上的加强免疫临床试验以国药灭活疫苗作为对照;公司在国内准备启动两项加强免疫基础上的II期临床研究,其中一项分别以科兴的灭活疫苗和智飞的蛋白疫苗作为对照组研究,另外一项则是在不同的基础免疫人群里进行的1剂或者2剂加强免疫研究。
图片来源:受访者提供
12月13日,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组下发《新冠病毒疫苗第二剂次加强免疫接种实施方案》(简称“《方案》”)。《方案》称,所有批准附条件上市或紧急使用的疫苗均可用于第二剂次加强免疫。优先考虑序贯加强免疫接种,或采用含奥密克戎毒株或对奥密克戎毒株具有良好交叉免疫的疫苗进行第二剂次加强免疫接种。

第二剂次加强免疫接种组合 图片来源:国家卫健委截图
从技术路线和涵盖的毒株看,以ReCOV为代表的大多数在研新冠疫苗,理论上能够满足当前市场需求;但从市场格局看,它们要面临激烈的市场竞争。
据国联证券12月研报统计,自今年9月份以来,NMPA(国家药品监督管理局)已批准了6家厂商新冠疫苗的紧急使用,分别为丽珠集团(SZ000513,股价35.15元,市值328.85亿元)、神州细胞(SH688520,股价67.20元,市值299.27亿元)、三叶草生物(HK02197,股价3.24港元,市值41.88亿港元)、四川大学华西医院研发的4款重组蛋白疫苗,康希诺(SH688185,股价195.41元,市值483.54亿元)的吸入型腺病毒载体疫苗,万泰生物(SH603392,股价134.05元,市值1214.59亿元)的鼻喷流感病毒载体疫苗。
其中,万泰生物针对的人群最为广泛,适用于18岁以上,未免疫任何新冠疫苗人群,以及既往已接种过1针、2针或3针其他新冠疫苗的人群。
从临床数据上看,万泰生物的有效性更为优异,重症保护率为100%,60岁以上人群保护效力不弱于18-59岁人群,并且终点病例基因分型均为奥密克戎株;从针对奥密克戎株的中和抗体水平来看,神州细胞和康希诺(吸入)更为优异,其中神州细胞的新冠疫苗为针对Alpha/Beta变异株的二价疫苗;康希诺的吸入剂型,与万泰生物的鼻喷剂型都能诱导人体的黏膜免疫,在防感染保护力上更优。
这些具有差异化优势的新冠疫苗是ReCOV的直接竞争对手,而ReCOV疫苗大概率会是瑞科生物首款商业上市的产品。
刘勇表示,目前公司正在紧张地进行产品上市方案的修订工作,其中包括如何在政府采购市场进行产品的准入和推广,也包括如何进行价格谈判等。
在生产上,此前公司设计的疫苗年产能在2亿剂以上。按照一般产品的上市规律,通常需要3-6个月时间可以达到满产的状态,如果未来产品顺利获批使用,公司将尽量缩短产能爬坡时间。
另外,考虑到未来新冠肺炎的传染病管理级别可能从“乙类甲管”回归到“乙类乙管”,新冠疫苗产品将相应产生相当规模的自费苗市场,如何让ReCOV在自费新冠疫苗市场上充分发挥优势,也是瑞科生物正在积极准备的内容。
封面图片来源:摄图网-500520040
如需转载请与《每日经济新闻》报社联系。
未经《每日经济新闻》报社授权,严禁转载或镜像,违者必究。
读者热线:4008890008
特别提醒:如果我们使用了您的图片,请作者与本站联系索取稿酬。如您不希望作品出现在本站,可联系我们要求撤下您的作品。
欢迎关注每日经济新闻APP
