每日经济新闻 2022-11-01 13:19:00
◎10月18日,科济药业公告,泽沃基奥仑赛注射液的新药上市申请获受理。《掘金创新药》研究员认为,拿到上市批准是科济药业叩开市场的敲门砖。由于CAR-T产品目前在国内仍然存在高昂的治疗费用等限制,在获得这张入场券后,科济药业仍前路漫漫。
◎近年来,东阳光药的王牌产品“可威”销售规模日益萎缩,寻找到下一个增长点是东阳光药迫在眉睫的任务。10月,东阳光药宣布门冬胰岛素注射液获批上市。但在其之前,国内已经有4家厂商的同类产品获批上市,东阳光药面临着不小的竞争压力。
每经记者|陈星 每经编辑|魏官红

《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。

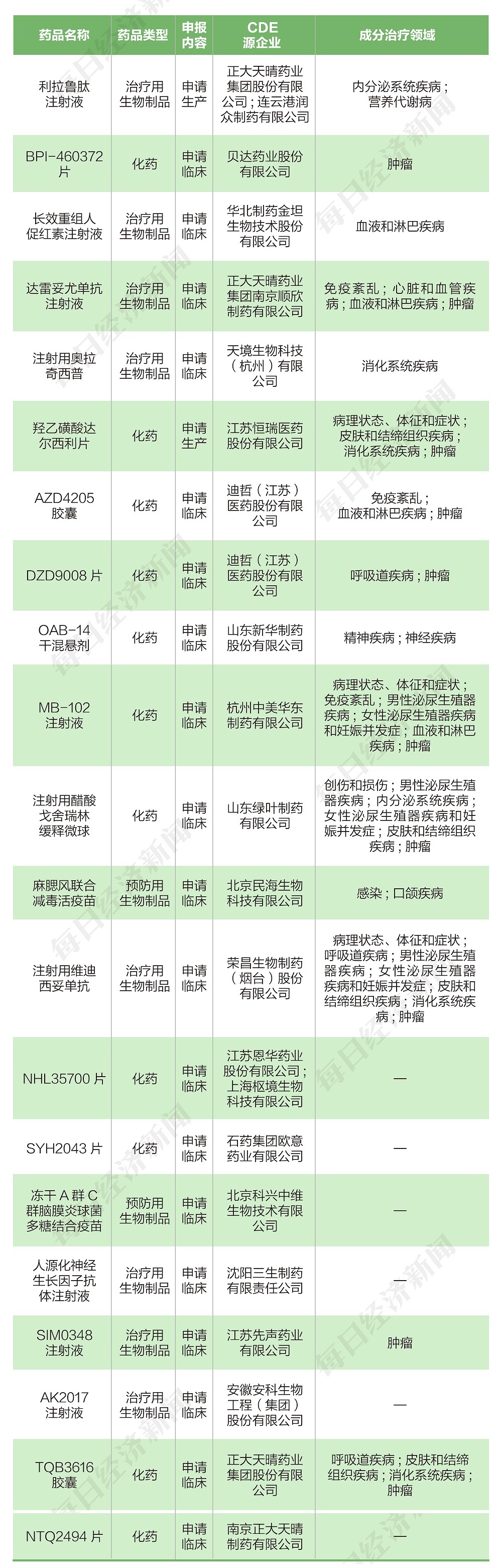
根据药渡数据,2022年10月10日至2022年10月23日期间,国家药品监督管理局药品审评中心(CDE)共收到17家上市公司(含上市公司控股公司)提交的21个化学新药、治疗用生物制品、预防用生物制品新药申请。

2022年10月10日至2022年10月23日期间,上市公司方面,中国生物制药控股子公司正大天晴递交1个新药生产申请、3个新药临床申请,迪哲医药递交2个新药临床申请。
恒瑞医药递交1个新药生产申请。贝达药业、华北制药、天境生物、新华制药、华东医药、绿叶制药、康泰生物、荣昌生物、恩华药业、石药集团、科兴生物、三生制药、先声药业、安科生物各递交1个新药临床申请。
1.科济药业CAR-T新药上市申请获受理 驯鹿生物/信达生物同靶点、适应症产品已获上市许可申请
10月18日,科济药业公告,中国国家药品监督管理局(NMPA)已受理泽沃基奥仑赛注射液(研发代号:CT053)的新药上市申请。泽沃基奥仑赛注射液是一种全人抗自体靶向BCMA的CAR-T细胞候选产品,拟用于治疗复发/难治多发性骨髓瘤。日前,该药物被CDE拟纳入优先审评。
目前,科济药业正在北美开展1b/2期临床试验,以评估泽沃基奥仑赛注射液用于治疗复发后/难治多发性骨髓瘤的安全性及疗效。2019年,泽沃基奥仑赛注射液获得美国FDA的再生医学先进疗法及孤儿药称号。
行业洞察:
科济药业在公告中称,多发性骨髓瘤是一种致命性的血液恶性肿瘤。数据显示,2020年,中国有超过2.1万例新病例和近1.62万例由于多发性骨髓瘤导致的死亡病例。患者平均生存期超过5年,中国在同期估计有11.3万名多发性骨髓瘤患者(包括新确诊和难治/复发者)。传统疗法下复发的患者,包括蛋白酶抑制剂、免疫调节剂及抗CD38单抗,预后较差,且治疗选项很少。
从第一个BCMA药物在2020年上市至今,已有4款针对该靶点的药物获批,涵盖了ADC、CAR-T和CD3双抗三种类型。
国内方面,与泽沃基奥仑赛注射液同靶点同类适应症的CAR-T产品——驯鹿生物与信达生物合作的伊基仑赛注射液(驯鹿生物研发代号:CT103A;信达生物研发代号:IBI326)治疗复发/难治性多发性骨髓瘤(R/R MM),获得NMPA上市许可申请(NDA)。此外,国内还有多款在研BCMA靶向CAR-T疗法,如亘喜生物的GC012F、西比曼生物的相关产品。
海外方面,全球已经批准两款BCMA靶向CAR-T疗法,即BMS/蓝鸟生物的Abecma和杨森/传奇生物的Carvykti。这两款产品均被FDA批准用于治疗既往接受过4种或更多种疗法的R/R MM成人患者。
除了同类CAR-T疗法外,FDA批准的BCMA/CD3双抗Tecvayli,也是CAR-T的强力竞争对手之一。Tecvayli的适应症,同样用于五线治疗难治性多发性骨髓瘤。相较于定制化、制备过程复杂的CAR-T产品,双抗有其自身优势。
公司点评:
去年6月18日,CAR-T细胞治疗公司——科济药业在港交所上市,发行价为32.8港元,募资净额约29.4亿港元,但上市首日即破发。
彼时,科济药业招股书显示,募集资金的30%将为核心候选产品BCMA CAR-T(CT053)的后续开发提供资金。2019年至2021年,公司分别亏损2.65亿元、10.64亿元和47.44亿元,三年合计亏损超60亿元。今年上半年,公司亏损3.76亿元,同比有所收窄。
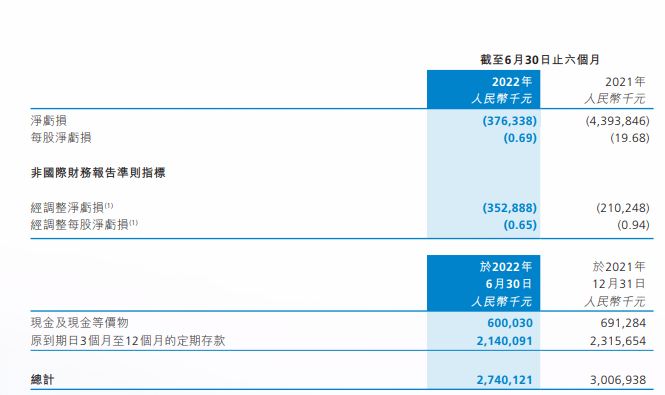
图片来源:2022年半年报截图
对于在无商业化产品困境中挣扎的科济药业来说,泽沃基奥仑赛注射液新药上市申请获得受理至关重要。但恶性血液病发病人群总体数量十分有限,远低于实体瘤的发病人数,若目标市场仅限于中国,那么目标群体的数量将进一步缩小。
除了泽沃基奥仑赛注射液外,今年9月,CDE官网显示,科济药业的“CT041自体CAR T细胞注射液”再度申报临床。CT041是一种潜在全球同类首创的、靶向CLDN18.2蛋白质的自体CAR-T细胞候选产品,拟用于治疗CLDN18.2阳性实体瘤,主要治疗胃癌/胃食管结合部癌及胰腺癌。按照公司设想,CT041将在2024年上半年在国内递交上市申请。
相较血液瘤,实体肿瘤的潜在市场更大,可选择的靶点及适应症也更多。
《掘金创新药》研究员认为,拿到上市批准是科济药业叩开市场的敲门砖。获得这张入场券后,由于CAR-T产品目前在国内仍然存在高昂的治疗费用、较低的医生及患者认知以及非一线治疗方案等限制,科济药业仍前路漫漫。

2、东阳光药非酒精性脂肪性肝炎新药获批临床 该领域尚无权威机构批准药物上市
10月10日,东阳光药HEC138671片获批临床,拟开展治疗非酒精性脂肪性肝炎(NASH)的研究。
HEC138671片是一款NASH新药。在该治疗领域,东阳光药还有2款1类新药在开展临床试验。其中,步入II期临床的HEC96719片是一款FXR激动剂,国内暂无同靶点药物获批;进入I期临床的HEC88473注射液是一款FGF21/GLP-1双特异性融合蛋白。
行业洞察:
非酒精性脂肪性肝病(NAFLD)是一种病因和发病机制复杂、以肝细胞显著脂肪变为病理特征的慢性代谢性疾病。随着全球范围内病毒性肝炎得到有效控制,NAFLD已成为当前慢性肝病的首要病因,全球患病率高达25%,其中约五分之一的患者将发展为非酒精性脂肪性肝炎(NASH)。NASH患者数量庞大,至今尚无任何权威机构批准的治疗药物上市——这也意味着,该市场存在巨大未满足的临床需求。
近年来,基于各种新理论和新靶点的NASH新药陆续进入临床试验,众多制药公司和生物医药公司加入NASH新药研发领域。然而,NASH新药研发并未达到预期。
根据业内人士观点,NASH作为一种合并代谢异常的长期慢性疾病,如何在确保用药安全的同时,达到理想的治疗效果,是目前面临的一大难题和挑战。基于NASH复杂的发病机制,存在个体异质性大、诊断障碍以及治疗终点的选择困难等情况,NASH的新药研发依然任重道远。
PPARα/γ双重激动剂Saroglitazar已在印度率先批准上市,这也是世界上第一个获批用于治疗非肝硬化性NASH的药物,但该药在国际上尚未被广泛接受。
公司点评:
在流感药物市场占有率一度达到90%的东阳光药近年来急切寻找新增长点。
随着流感患病人数持续下降,东阳光药的奥司他韦“可威”从一度达到60亿元的销售规模急剧萎缩。东阳光药的业绩也受到拖累。
近段时间以来,东阳光药频频发布新药研究进展。除HEC138671获批临床外,门冬胰岛素注射液获批上市、芬戈莫德胶囊首仿专利挑战成功……公开数据显示,目前东阳光药有33款1类新药处于获批临床及以上阶段,5款处于III期临床阶段。
但值得注意的是,随着研发进入后期关键阶段,东阳光药需要的“弹药”越来越多,而可威的造血能力已经大不如前。
从研发投入来看,东阳光药在2022中期报告中提到,当期研发投入8660万元,比上年同期减少29.1%。其中费用化支出4090万元,资本化支出4570万元。在研发进展上,公司只披露了内分泌以及代谢领域药物研发情况。而在2018年,东阳光药研发投入为2.241亿元,2019年上半年研发投入1.14亿元。
以门冬胰岛素为例,东阳光药并非头个拿下门冬胰岛素注射液的厂家,在其之前,国内已经有4家厂商的同类产品获批上市。因上市时间原因,错失上一轮集采机会。两年采购周期结束后,东阳光药有望迎来下次机会,但面对甘李药业等胰岛素价格“杀手”,东阳光药仍面临不小的竞争压力。
对于东阳光药来说,眼下更紧迫的是在已有产品里挖掘下一个造血功能强劲的品种。
封面图片来源:摄图网-401491749
如需转载请与《每日经济新闻》报社联系。
未经《每日经济新闻》报社授权,严禁转载或镜像,违者必究。
读者热线:4008890008
特别提醒:如果我们使用了您的图片,请作者与本站联系索取稿酬。如您不希望作品出现在本站,可联系我们要求撤下您的作品。
欢迎关注每日经济新闻APP
