2025-12-04 20:45:08
11月24日至28日,医药生物指数涨1.5%,细分板块原料药等领涨,血液制品收跌,资金情绪谨慎。凌科药业拟赴港IPO,核心产品面临同类竞争。国家药监局披露110条临床试验登记信息,4款创新药获批。众生药业启动儿童抗甲流药物III期试验入组,科伦博泰SKB500启动小细胞肺癌II期临床。劲方医药创始人吕强谈市场起伏,称将与投资者保持顺畅沟通。
每经记者|金喆 每经编辑|魏官红
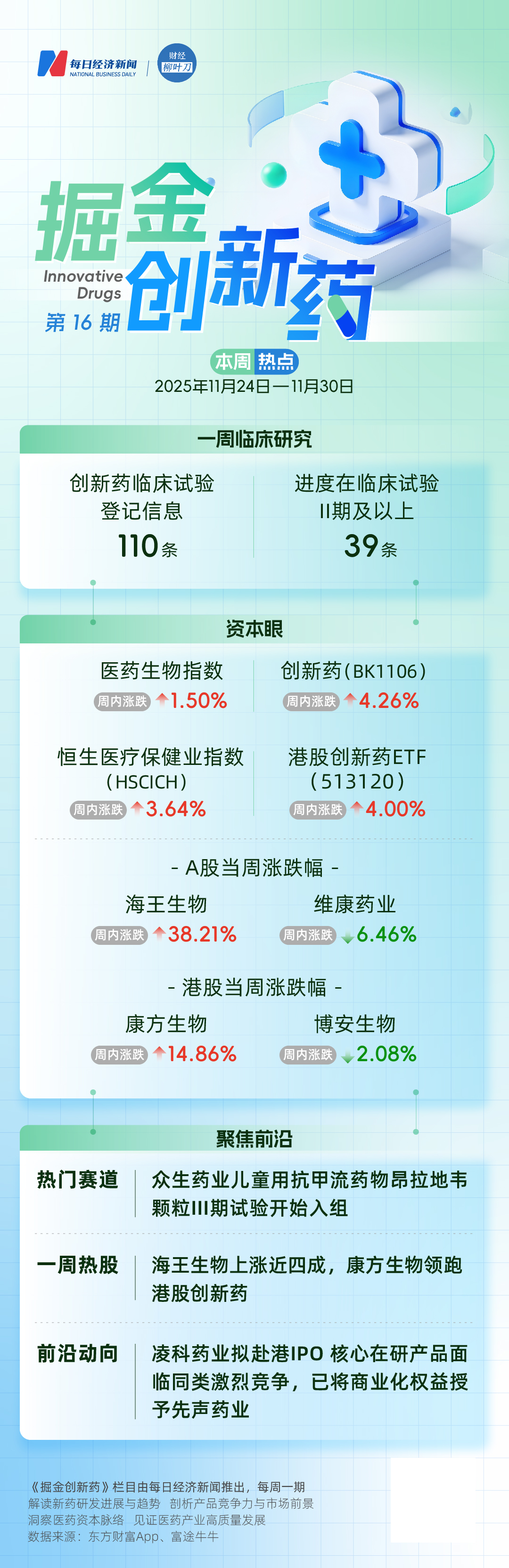
一周行情
11月24日至11月28日,医药生物指数收涨1.50%,跑赢上证指数0.10个百分点,连续两周上涨。创新药(BK1106)周内收涨4.26%;恒生医疗保健业指数(HSCICH)周内上涨3.64%;港股创新药ETF(513120)周内收涨4.00%。
一周点评
资金情绪由此前的集中加仓转向更偏谨慎
11月24日至11月28日,医药生物板块跑输“全A”,但跑赢沪深300。从细分板块来看,原料药、化学制剂和医药流通品领涨,血液制品是唯一收跌板块。
在经历年内一轮强势上涨后,医药板块的上行势头近期有所放缓,“翻倍基”数量也明显收缩。数据显示,三季度医药主题基金一度出现多只翻倍的阶段性高点,但截至11月28日,仅剩中银港股通医药A、创金合信全球医药生物A两只产品维持翻倍收益。
从平均收益来看,截至11月底,医药类主题基金相比9月净值高点处回撤约10%。头部医药ETF规模近三个月出现下滑,资金情绪由此前的集中加仓转向更偏谨慎的观望。
一周IPO动向
凌科药业拟赴港IPO,核心在研产品面临同类激烈竞争
近日,港交所官网披露,凌科药业(浙江)股份有限公司递表港交所主板,中信证券、建银国际为联席保荐人。
根据招股书介绍,凌科药业成立于2017年,定位为自身免疫及炎症疾病领域创新药企,核心管线聚焦JAK-STAT信号通路,拥有三款临床阶段候选药物。其中,LNK01001(高选择性第二代JAK1抑制剂)已启动特应性皮炎、类风湿关节炎及强直性脊柱炎三项III期临床,计划于2026至2027年提交新药申请。
据不完全统计,全球已有12种JAK抑制剂获得批准。凌科药业主攻的是第二代高选择性和第三代组织特异性JAK(即Janus kinase,是一种非受体型蛋白酪氨酸激酶)抑制剂的研发。不过,LNK01001作为第二代JAK1抑制剂,面临同类产品的激烈竞争:恒瑞医药艾玛昔替尼已获批上市,辉瑞托法替尼、艾伯维乌帕替尼已占据主要市场份额。
2022年,凌科药业与先声药业签订协议,授予其在中国商业化LNK01001的类风湿关节炎及强直性脊柱炎适应证权益,由先声负责推广并支付服务费,具体分成比例未披露。
招股书显示,2023年、2024年及2025年前9个月,凌科药业的研发支出分别约为1.86亿元、2.23亿元和1.21亿元,净亏损分别约为2.60亿元、3.12亿元和1.45亿元。
截至2025年9月底,凌科药业现金及等价物1.467亿元。若IPO募资不及预期,核心产品III期临床(需招募超3000例患者,预计费用超3亿元)可能因资金不足被迫中断。
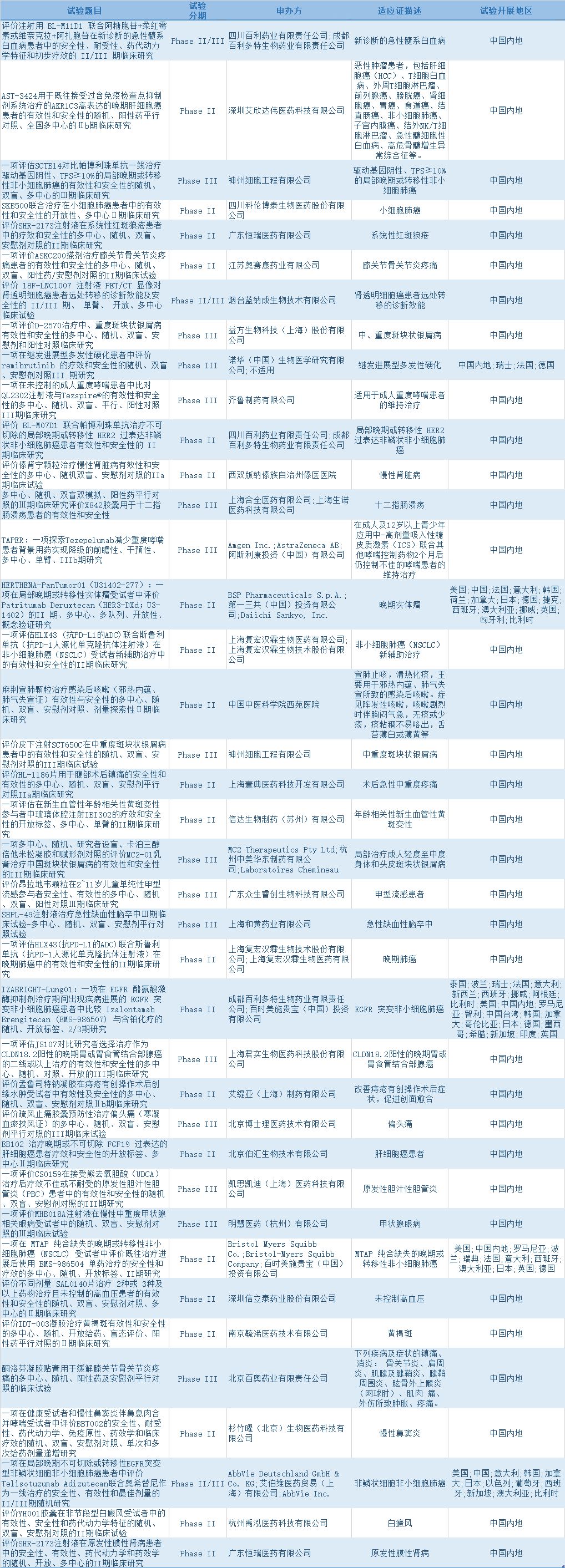
一周临床试验动向
根据医药魔方提供的数据,11月24日至11月28日,国家药品监督管理局药品审评中心共披露110条临床试验登记信息,其中39条为处于临床试验II期及以上的创新药新登记临床试验信息。
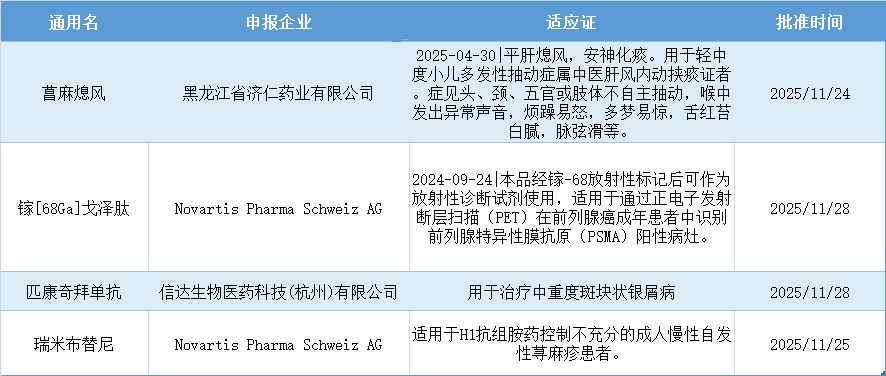
当周,有4款创新药获批。
众生药业儿童用抗甲流药物昂拉地韦颗粒III期试验开始入组
药物临床试验登记与信息公示平台数据显示,广东众生睿创生物科技有限公司的评价昂拉地韦颗粒在2岁~11岁儿童单纯性甲型流感参与者安全性、有效性的多中心、随机、双盲、阳性对照Ⅲ期临床研究已启动。临床试验登记号为CTR20254478,首次公示信息日期为2025年11月26日。
广东众生睿创生物科技有限公司为众生药业子公司。《每日经济新闻》记者注意到,该临床试验的试验组为昂拉地韦、安慰剂,对照组为奥司他韦、安慰剂,目标入组114人。
儿童抗病毒药物研发门槛高、选择少。在现有儿童流感治疗中,奥司他韦颗粒剂是经典选择,但病毒潜在耐药性及部分儿童服药依从性问题仍是临床关切。玛巴洛沙韦目前仅批准用于5岁以上患儿,无法覆盖更年幼的2岁~5岁群体。
众生药业将昂拉地韦的适应人群拓展至2岁~11岁儿童,不仅是其产品管线的重要深化,更是精准切入临床需求迫切的细分市场。
目前处于流感流行季节,有利于试验人群入组。众生药业公告称,III期临床试验完成首例参与者入组和给药。昂拉地韦片已在2025年5月获批上市,用于成人治疗,治疗青少年的III期试验入组也较顺利。昂拉地韦颗粒II期试验结果理想。此次入组对短期业绩无重大影响,后续临床试验等存在不确定性,公司将依规披露进展。
科伦博泰注射用SKB500启动II期临床 适应证为小细胞肺癌
药物临床试验登记与信息公示平台数据显示,科伦博泰的SKB500联合PD-L1抑制剂塔戈利单抗治疗在小细胞肺癌患者中的有效性和安全性的开放性、多中心Ⅱ期临床研究已启动。临床试验登记号为CTR20254756,首次公示信息日期为2025年11月28日。
SKB500是科伦博泰利用OptiDCTM平台技术研发的新型ADC药物,主要用于治疗晚期实体瘤。本次试验主要目的为评估SKB500联合治疗在小细胞肺癌患者中的安全性、耐受性和初步抗肿瘤活性;次要目的为评估其药代动力学特征、免疫原性;其他目的为评估生物标志物与疗效的相关性。目前,该试验状态为进行中(尚未招募),目标入组人数80人。
小细胞肺癌恶性程度高、易复发转移,长期以来治疗选择有限(依赖放化疗和少数免疫疗法)。近年已有PD-L1抑制剂(如阿替利珠单抗、度伐利尤单抗)联合化疗获批一线治疗,但后线治疗仍缺乏高效方案。SKB500针对该适应证,若能取得积极数据,有望填补临床需求缺口,市场潜力显著。
吕强是科学家里走出的创业者。
2008年回国后,他在多家国内知名药企担任过高管,但和许多海归科学家出身的创业者一样,他觉得没过足“创新瘾”,2017年8月,吕强在上海张江创办了劲方医药。
劲方医药是幸运的,诞生于中国创新药发展的红利期,又赶在行业回暖的“黄金窗口”登陆资本市场。但二级市场的考验也是现实的:在港交所上市当天,劲方医药成为今年上市首日涨超100%的18A企业之一,但旋即赶上了10月之后的创新药板块调整期。
作为创始人,吕强怎么看待市场的起伏和行业的正道?他又是如何平衡投资人与产品研发之间的关系?要怎么遣兵布阵,让某个产品、某个适应证在商业化阶段找到合适的位置?怎么与一二级市场投资者保持顺畅沟通?
11月17日,这位自称“在二级市场是新生”的行业老兵,和《每日经济新闻》记者展开了一次坦诚的对话。有趣的是,在对话的结尾,他说自己只剩8分钟了——“下一个投资人就要过来沟通,一起在办公室里吃盒饭了”。

如需转载请与《每日经济新闻》报社联系。
未经《每日经济新闻》报社授权,严禁转载或镜像,违者必究。
读者热线:4008890008
特别提醒:如果我们使用了您的图片,请作者与本站联系索取稿酬。如您不希望作品出现在本站,可联系我们要求撤下您的作品。
欢迎关注每日经济新闻APP
