每日经济新闻 2023-12-12 16:38:00
◎对于公司赚钱赶不上花钱快的问题,张译有自己的认识。他认为“好的企业,一定是钱永远不够花,(钱)有地方投,发展速度才快。”目前,狂犬疫苗是依生生物赚钱和花钱的“交点”:它既是公司唯一的收入来源,也是进展最快、目前花钱最多的临床项目。
每经记者|林姿辰 每经编辑|陈俊杰
12月12日,依生生物宣布,公司自主研发的新型免疫抗肿瘤药物YS-ON-001已在天津肿瘤医院完成I期临床研究,研究结果显示该药物具有良好的安全性和耐受性(无剂量限制性毒性),可有效诱导肿瘤免疫反应,初步显示出YS-ON-001具有抗肿瘤效果。
在此不久前,公司10月24日宣布收到纳斯达克股票上市资格部门工作人员的书面通知,公司普通股在过去连续31个工作日的收盘价低于每股1.00美元,虽然这不会导致公司立即退市,但也为公司的发展埋下一颗隐形炸弹。
好消息和坏消息,几乎同时降临到这家估市值约4776万美元的中概股公司,在市场上也未激起太多水花。而在几年前,手握皮卡重组蛋白新冠疫苗的依生生物备受资本追捧,并于今年3月成功登陆纳斯达克完成了3600万美元融资。如今,曾经被一级市场投资人看好的国产疫苗佐剂来到了最后的试验场,却恰逢资本寒冬。
近日,依生生物董事长、国内疫苗行业老兵张译接受了《每日经济新闻》记者的专访,这个操着浓厚河南口音的疫苗“老兵”从开封走到北京,在新冠疫苗普及的末尾实现了公司上市的梦想,也必须在行业寒意中寻觅破局之路。
作为成立21年的老牌疫苗企业,依生生物于今年3月17日在大洋彼岸敲钟上市,是首个通过SPAC(海外借壳上市)登陆纳斯达克的中概股Biotech(生物科技公司),投资方包括海松资本、奥博资本、高瓴资本等十多家国际性医疗专业投资机构。
与近几年在国内上市的多家疫苗企业不同,作为创始人的张译的创业故事不是年轻科学家回国创业,而是从地方防疫站出发,直到46岁开始下海从“农村包围城市”,他甚至自嘲“学历很浅、学识很浅”。但在2002年,张译通过技术合作的方式研制出的狂犬病免疫球蛋白“依生保尔”上市后大获成功,次年参与开发了国内首个无铝佐剂的冻干、人用狂犬病纯化疫苗“依生君安”,2020至2023财年,依生生物的营业收入分别为1.84亿元、5.02亿元、6.87亿元,几乎全部来自这款唯一的上市产品。
这款产品的商业化之路颇为曲折——2005年至2013年,依生生物在先前的生产设施生产并商业化“依生君安”,之后因五年期的GMP认证届满停止生产。2019年7月,公司在沈阳新建生产设施获得了GMP认证,于2020年2月恢复生产“依生君安”并自2020年10月起开始销售及营销。
停产五年给依生生物带去了不小的影响。一方面,公司基本面受挫,资金链面临挑战。根据招股说明书(指港股文件,下同),公司此前未能缴纳税项及相应的滞纳金达1.256亿元,主要原因是“依生君安”停售后,公司优先把有限的营运资金投入到候选自研产品的研发;再比如截至2020年3月31日,公司的应付工资金额达到1.18亿元。
另一方面,公司和监管方面的关系变得微妙。2014年,公司与中国食品药品检定研究院就授出若干批“依生君安”狂犬病疫苗的批签发合格证的时间存在分歧,并就研究院拒绝批签发及未能在法定期限内给出检测结果的通知对其提起了行政诉讼,最终该诉讼因缺乏司法管辖权被驳回。在招股说明书中,依生生物亦在阐述生产上市产品及未来获批候选在研产品的商业用品的能力时,提到了“与监管机构保持良好关系的能力”。
而从依生生物近几年的业绩看,公司净亏损在不断扩大,2020至2023财年分别为0.39亿元、1.06亿元、1.45亿元。截至2023财年年末,依生生物账上现金仅3.7亿元,但公司的销售费用高达2.72亿元,研发费用达3.18亿元。
对于公司赚钱赶不上花钱快的问题,张译有自己的认识。他认为“好的企业,一定是钱永远不够花,(钱)有地方投,发展速度才快。”目前,狂犬疫苗是依生生物赚钱和花钱的“交点”:它既是公司唯一的收入来源,也是进展最快、目前花钱最多的临床项目。
张译表示,创业之初之所以选择这一赛道,是因为自己曾在防疫站从事狂犬病防治工作,知道狂犬病发病致死率近乎100%,预防将是一种长期需求。狂犬疫苗是国内最早商品化的疫苗,公司的“依生君安”可以将完全产生抗体的时间从42天缩减至14天,在早期市场中的单品种占有率最高,近几年“依生君安”逐渐扩产,一直处于供不应求的状态,市场占有率已超10%,有望在明年提升到25%至30%。
但不容忽视的是,狂犬疫苗赛道已经很拥挤。截至2022年末,国内共有9家疫苗企业生产人用狂犬病疫苗,市场占有率第一的成大生物曾在2022年年报中表示“自2018年下半年以来市场供不应求的格局已经改变,市场竞争态势明显”。

2020年中国批签发结果中采用Vero细胞技术的已上市人用狂犬病疫苗 图片来源:依生生物招股说明书
张译认为,新的机会蕴藏在免疫程序,即“打几针”“打多久”中——目前,市面上狂犬疫苗的免疫程序大多在三周或四周之内完成,依从性仍然较差,有很大的优化空间,而公司的皮卡技术有望将狂犬疫苗的免疫程序缩短至7天。
10月31日,依生生物宣布自主研发的皮卡(PIKA)狂犬病疫苗Ⅲ期临床试验受试者全部完成入组。这项随机、双盲、阳性对照的多中心临床研究,主要用于评估该疫苗在成人狂犬病暴露后预防中的免疫原性、安全性和批次间一致性。此次临床试验在巴基斯坦、菲律宾等多个国家多个中心开展,共入组4500人。
据张译介绍,这款人用皮卡狂犬病疫苗由皮卡佐剂同时诱导体液免疫和细胞免疫,将是全球首创治疗性皮卡狂犬病疫苗。此前,WHO(世界卫生组织)疫苗专家组官方文件将该疫苗评价为创新型的狂犬病疫苗;考虑到该疫苗对抵御狂犬病病毒感染具有独特的机理和功效,FDA(美国食品药品监督管理局)已授予该疫苗暴露前和暴露后预防狂犬病毒感染的孤儿药资质,同时国家药品监督管理局也将该疫苗定位为治疗性生物制品,不过目前其国内临床试验仍处于Ⅰ期临床阶段。
“非常感谢投资者,他们有这个独到的眼光看好我们,给我们钱才让公司活了下来。”在依生生物面临停产危机时,高瓴资本、3W Capital、AIHC、海通国际等知名机构出手相助,张译对此非常感激,也知道公司之所以能吸引这些知名机构,是因为自研的皮卡佐剂。
简单来说,疫苗佐剂是疫苗的一种添加剂,可以助力疫苗的“免疫值”飙涨。当它先于抗原或与抗原混合注入机体后,能够增强机体对抗原的免疫应答或者改变免疫反应的类型。目前全球应用最为广泛的佐剂是铝佐剂,常用于人用疫苗开发。
张译表示,铝佐剂可以吸附病毒,然后缓慢释放,不停地刺激机体产生抗体,但由于会引起注射部位反应,诱导细胞免疫的能力较弱,铝佐剂不适用于狂犬病等紧急疾病。而公司的皮卡佐剂(PIKA)是一种靶向TLR3、RIG-I、MDA5受体的佐剂,能同时促进细胞免疫和体液免疫(即人体免疫系统的两套体系)应答,获得更强的免疫反应,特别是对提升非特异性细胞免疫水平具有更重要意义。值得一提的是,狂犬病防治最关键的就是非特异性细胞免疫应答。
“除了杀灭病毒,细胞免疫还有杀灭肿瘤细胞等多种作用,所以皮卡佐剂具备延展为一大技术平台的潜力,其中包括治疗性疫苗,既可以用于健康人群的预防,也可以用于患者的治疗。”
目前,依生生物将皮卡佐剂与成熟的疫苗作用机制(例如狂犬病和乙型肝炎病毒疫苗的作用机制)相结合,开发针对特定病毒性感染的创新型疫苗产品线,目前拥有在中国或新加坡处于不同临床试验阶段的三个候选在研产品,包括皮卡狂犬病疫苗、皮卡YS-ON-001及皮卡YS-HBV-001;及四种针对COVID-19、HBV(乙型肝炎病毒)、流感及具有巨大医疗需求的癌症的临床前阶段候选在研产品。
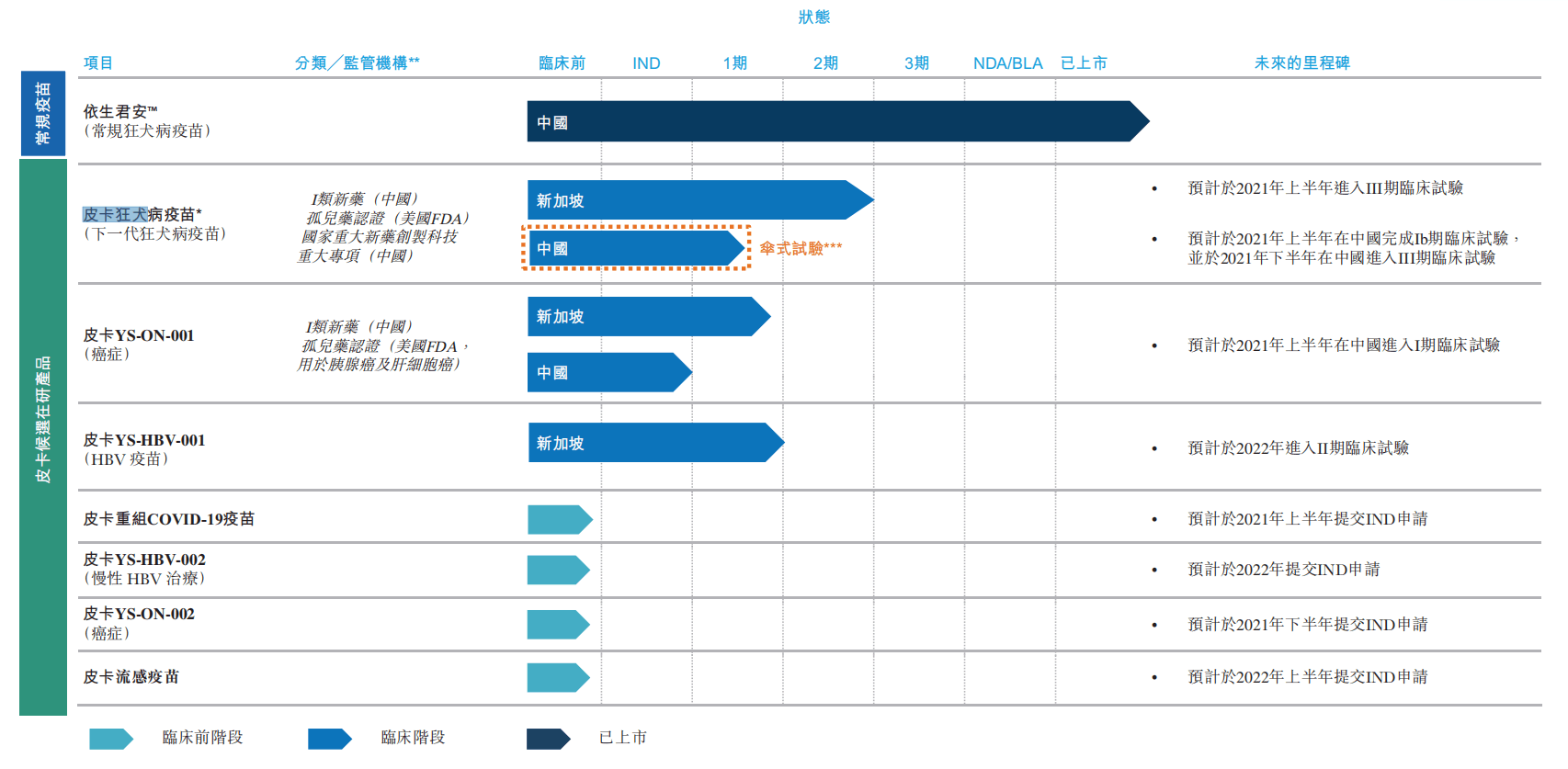
依生生物已上市产品及候选在研产品 图片来源:依生生物招股说明书
2021,在依生生物向港交所递交招股说明书时,最受人期待的皮卡疫苗是皮卡重组新冠疫苗。当时,这款疫苗已经获得FDA对mRNA及腺病毒载体疫苗加强针的临床试验批准,是首个在中国研发且获得FDA批准临床试验的重组蛋白新冠疫苗项目。
不过,这款疫苗至今未在美国上市,也未在国内获批临床,最新公开进展是在菲律宾、阿联酋提前完成针对灭活疫苗加强针的Ⅲ期临床入组,2022年12月20日最后一名受试者完成入组。
重磅产品错过了最佳时间上市,张译承认“有些尴尬”,但也认为未来还有储备价值。他坦言,目前的几款在研产品大多处于早期临床阶段,后续临床都需要新融资推进,具体时点取决于临床试验取得结果的时间。
“佐剂之于疫苗,如同芯片之于手机”,从业内流传的这句话中,不能看出疫苗佐剂在疫苗产业中的重要位置,即从类型、强度、宽度、持久性四个维度调节疫苗的免疫应答,直接决定疫苗的安全性和有效性。2022年,国家《“十四五”医药工业发展规划》将疫苗新佐剂列入重点开发的生物药技术,至今国内仍未有铝佐剂之外的第二款疫苗佐剂获批上市,依生生物自主研发的皮卡佐剂技术,作为一种新型佐剂,早在2018年就被列入国家重大新药创制项目,但至今也仍未有皮卡佐剂相关疫苗产品获批,可见,新佐剂已成为公认的疫苗行业“卡脖子”问题。
这与国外存在巨大差距。张译表示,佐剂一般不会作为一种药物被单独批准,而是作为疫苗的组成部分整体获批。目前,FDA已批准6种新型佐剂上市,包括MF59、AS04、AS03、AS01和CpG1018及Matrix-M(新冠紧急使用),均在人用疫苗上使用。但国内佐剂研发仍处于合作引入或对已有佐剂进行优化阶段,尚未形成系统性的研发体系和产业化能力。
这种差距的背后实则是基础科研的差距。2007年,在世卫组织召开的一个专家会上,张译结识了许多国外同行,并有机会去国外考察,在受邀前往NIH(美国国立卫生院)参观时,张译发现NIH的实验室中有很多中国人,都是博士毕业在那里做实验员。由于彼时国内外科研人员的收入存在巨大鸿沟,张译无法直接从国外引进人才,于是张译在两年后在美国成立了公司;2010年,依生生物全资收购了新加坡皮卡佐剂技术公司NEWBIOMED PIKA PTE. LTD.,形成了公司在中国、美国、新加坡的三地布局,目前公司在北京、新加坡、美国马里兰均设有独资研发中心,许多临床注册地均在海外。
“现在我们开发产品,就要站到世界的视野里边去看问题,不能只看到中国的产品如何更新换代,也要考虑如何赶上世界水平和超越世界水平。”
张译表示,目前国内监管机构对产品的安全性非常重视,对于创新产品(如公司皮卡重组新冠疫苗)的审批态度更为谨慎,国外则更重视产品的创新性,更容易走加速通道,未来公司的创新产品可能会优选美国等发达国家上市以收回成本,但必须承认,虽然目前公司的海外临床项目没有在制度方面遇到“水土不服”的问题,但资金还是一个主要问题,自己仍然期待国内创新药审批能有续提速。
在资本寒冬下,依生生物也面临着几乎所有创新药企或Biotech(生物科技公司)的烦恼:由于商业化产品单一、中概股估值普遍偏低等诸多原因,公司上市以来的股价一路走低,截至发稿时公司股价仅0.601美元。面对这个已经低于账面资金的数字,张译直言“很令人沮丧”,但像多年前公司面临停产危机时一样,他对公司产品管线和融资能力保持乐观。
“原来满地都是钱的时候,资本不用那么谨慎,现在他们谨慎归谨慎,但还是永远会投资最有希望的企业,他们也在找出口,看到好的投资项目一定还是会投资的。”张译说。
封面图片来源:企业供图
如需转载请与《每日经济新闻》报社联系。
未经《每日经济新闻》报社授权,严禁转载或镜像,违者必究。
读者热线:4008890008
特别提醒:如果我们使用了您的图片,请作者与本站联系索取稿酬。如您不希望作品出现在本站,可联系我们要求撤下您的作品。
欢迎关注每日经济新闻APP
