每日经济新闻 2022-05-22 11:06:59
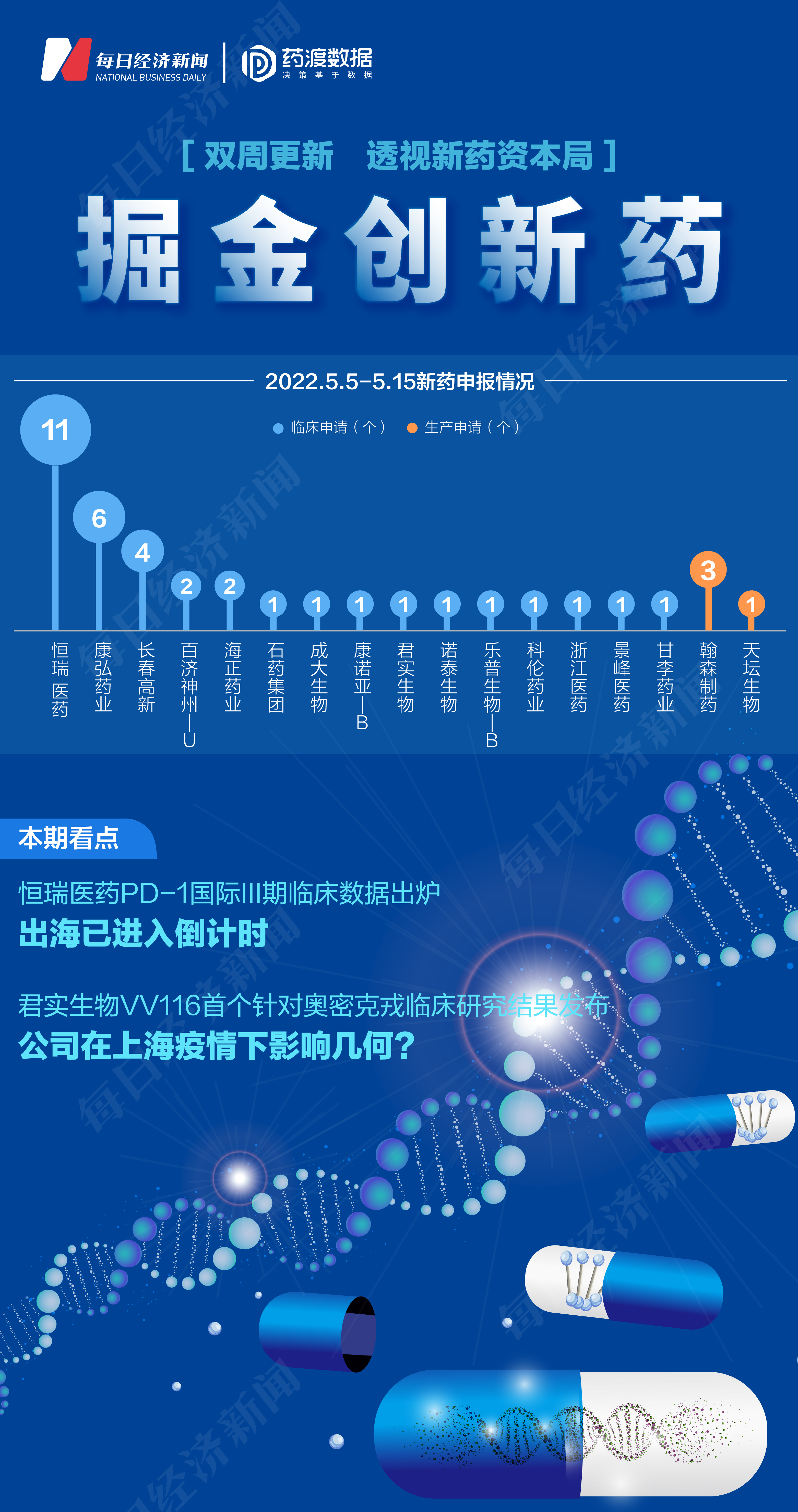
◎根据药渡数据,2022年5月5日至5月15日,国家药品监督管理局药品审评中心(CDE)共收到17家上市公司提交的39个化学新药、治疗用生物制品新药申请。
◎5月12日,恒瑞医药在公告中披露了其自主研发的PD-1单抗(卡瑞利珠单抗)联合甲磺酸阿帕替尼片的国际多中心Ⅲ期临床试验的最新结果。经由独立数据监察委员会(IDMC)判定,该临床试验的主要研究终点结果达到方案预设的优效标准。
每经记者|许立波 上海报道 每经编辑|董兴生
《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
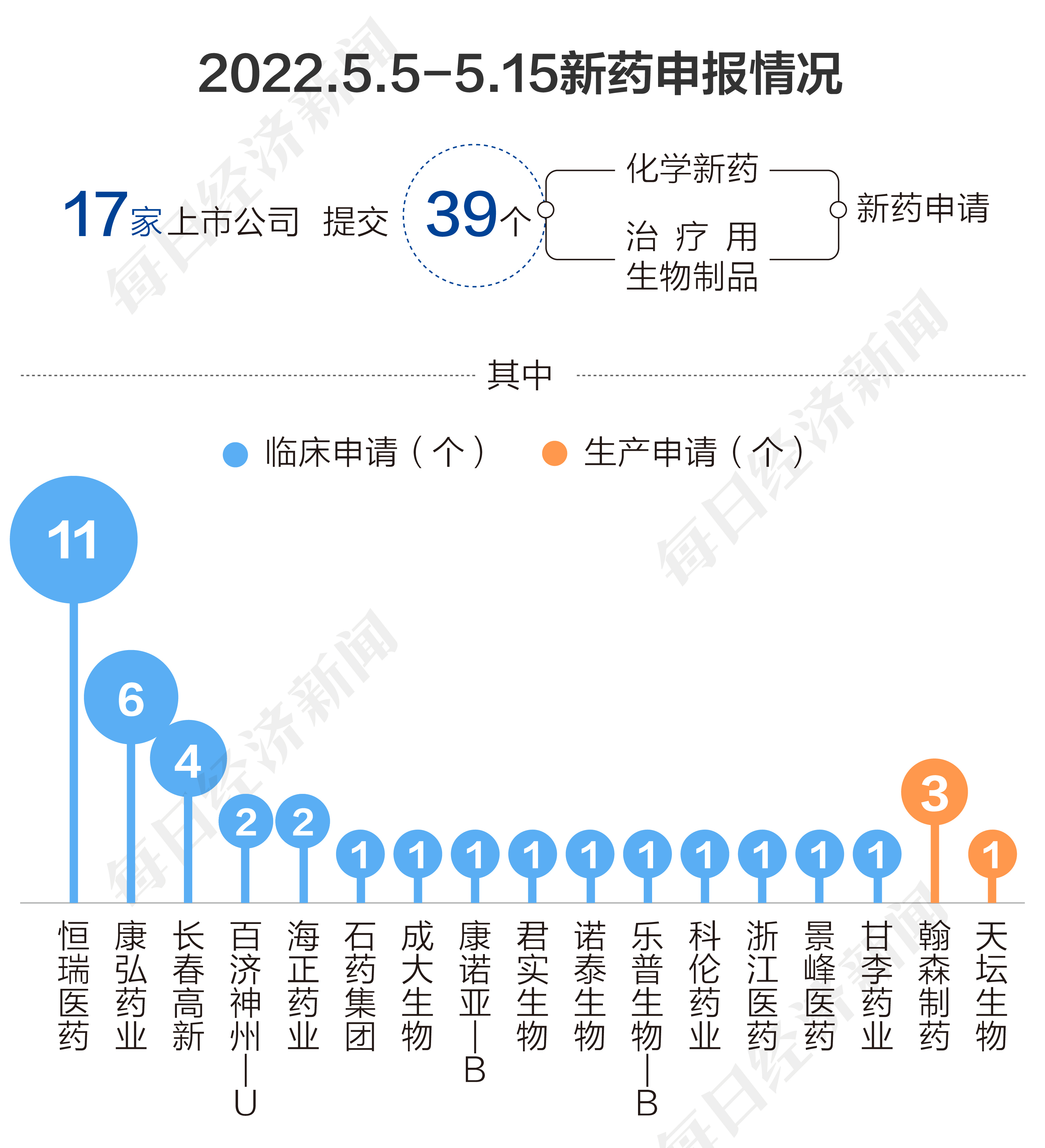
根据药渡数据,2022年5月5日至5月15日,国家药品监督管理局药品审评中心(CDE)共收到17家上市公司提交的39个化学新药、治疗用生物制品新药申请。

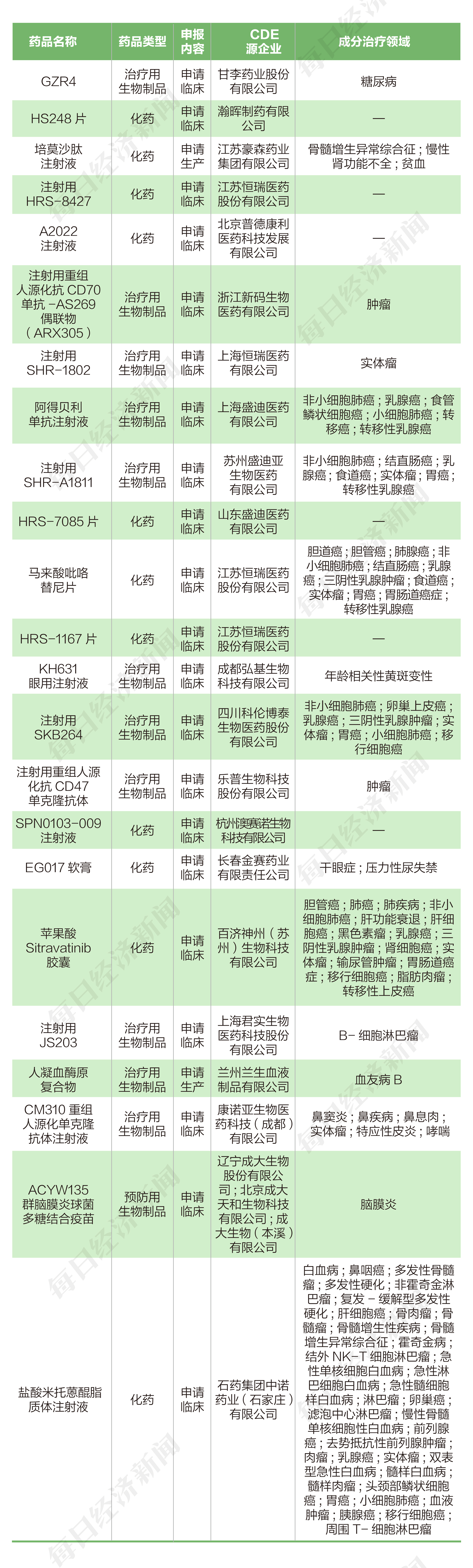
2022年5月5日至5月15日期间,上市公司方面,恒瑞医药(600276.SH)申报11个临床申请,康弘药业(002773.SZ)申报6个临床申请,长春高新(000661.SZ)申报4个临床申请,百济神州-U(688235.SH)、海正药业(600267.SH)各申报2个临床申请,甘李药业(603087.SH)、景峰医药(000908.SZ)、浙江医药(600216.SH)、科伦药业(002422.SZ)、乐普生物-B(02157.HK)、诺泰生物(688076.SH)、君实生物(01877.HK)、康诺亚-B(02162.HK)、成大生物(688739.SH)、石药集团(01093.HK)各申报1个临床申请;翰森制药(03692.HK)申报3个生产申请,天坛生物(600161.SH)申报1个生产申请。
1、恒瑞医药PD-1国际III期临床数据出炉,出海已进入倒计时
5月12日,恒瑞医药在公告中披露了其自主研发的PD-1单抗(卡瑞利珠单抗)联合甲磺酸阿帕替尼片的国际多中心Ⅲ期临床试验的最新结果。经由独立数据监察委员会(IDMC)判定,该临床试验的主要研究终点结果达到方案预设的优效标准。
该临床试验共入组543名受试者,按照1:1随机入组,分别接受卡瑞利珠单抗(200mg,每2周注射1次)联合阿帕替尼(250mg,每日口服1次)或索拉非尼(400mg,每日口服2次)治疗。
值得注意的是,卡瑞利珠单抗的这项III期临床研究由南京金陵医院肿瘤中心的秦叔逵担任全球主要研究者,全球13个国家和地区的95家中心共同参与,也是恒瑞医药开展的首个国际多中心III期临床研究。
研究结果表明,卡瑞利珠单抗联合阿帕替尼对比索拉非尼,作为一线治疗方案,可以显著延长晚期肝细胞癌患者的无进展生存期(PFS)以及总生存期(OS)。
目前,卡瑞利珠单抗联合阿帕替尼用于既往未接受过系统治疗的不可切除或转移性肝细胞癌患者的一线治疗的上市许可申请已获得中国国家药品监督管理局受理,恒瑞医药称,计划近期向FDA递交新药上市的沟通交流申请。

图片来源:恒瑞医药官网
行业洞察:
恒瑞医药公告显示,目前已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤五大瘤种中获批8个适应症,与百济神州的替雷利珠单抗并列为国内获批适应症最多的PD-1单抗。
而除了这两家之外,目前国内另有5款抗PD-1单克隆抗体获批上市,分别为君实生物的特瑞普利单抗、信达生物的信迪利单抗、正大天晴和康方生物的派安普利单抗、誉衡生物的赛帕利单抗和复宏汉霖的斯鲁利单抗。
国外则有4款PD-1单克隆抗体获批上市,分别为默沙东的帕博利珠单抗、百时美施贵宝的纳武利尤单抗、再生元制药的cemiplimab和葛兰素史克的dostarlimab,帕博利珠单抗和纳武利尤单抗均已在国内获批上市。
目前,业内一致的观点是,在国内市场竞争趋向白热化的背景下,各家PD-1出海是大势所趋。信达生物、君实生物、百济神州、康方生物均已向FDA递交了新药上市申请,从出海的进度上看,恒瑞医药的卡瑞利珠单抗相比其竞争者已稍显落后。
不过,总体上来说,国产PD-1的出海之路走得并不顺畅。今年2月,信达生物的信迪利单抗因未能实现“差异化”,被FDA要求补充额外临床试验,以证明其产品在美国人群的适用性;5月4日,君实生物发布公告称,FDA要求进行一项质控流程变更。君实生物计划与FDA直接会面,并预计于2022年仲夏之前,重新提交特瑞普利单抗的生物制品许可申请。
公司点评:
从恒瑞医药的年报来看,公司降本增效、持续进行研发投入、出海加速的意图明显。数据显示,公司2021年累计研发投入62.03亿元。其中,海外研发投入共计12.36亿元,占总体研发投入的比重达到19.93%。
国金证券研报统计,恒瑞医药已在中国及美国、欧洲、澳大利亚、日本建有研发中心,研发团队达到5400多人,其中海外研发团队170余人。目前,公司共计开展近20项国际临床试验,其中国际多中心III期项目7项,并有10余项研究处于准备阶段。
《掘金创新药》研究员认为,尽管目前国产PD-1的FDA申请接连受挫,但对于出海进展稍显落后的恒瑞医药来说未必是坏事,卡瑞利珠单抗如果能贯彻“差异化创新”的原则,或许能够在出海之路上实现弯道超车。同时,随着国际化进程的推进,海外市场销售收入有望成为恒瑞医药新的业绩增长点。
2、君实生物VV116首个针对奥密克戎临床研究结果发布 公司在上海疫情之下影响几何?
5月18日,“华山感染”官方微信号发布了君实生物抗新冠病毒小分子口服药物VV116在中国奥密克戎感染受试者中的首个临床研究数据。
研究数据显示,在首次核酸检测阳性5日内使用VV116的奥密克戎感染患者,其核酸转阴时间为8.56天,小于对照组的11.13天。有症状的患者中,在本研究的用药时间范围内(首次核酸阳性2~10天)给予VV116,均可以缩短患者的核酸转阴时间。在药物安全性上,使用了VV116的患者中,未观察到严重不良反应。
但文章也指出,作为一项开放性、前瞻性队列研究,本研究所纳入的样本量有限,所有受试者均未发展为重症或危重症。因此,本研究未能收集到足够多的数据进一步分析VV116是否对于奥密克戎感染重症化具有预防作用,仅初步评价了轻症患者中核酸转阴这单一指标。
5月上旬,在乌兹别克斯坦召开的新闻发布会上,VV116的价格得到首次披露,其在乌兹别克斯坦的定价为每疗程185美元,折合人民币约1234元。
行业洞察:
目前,获批的国产新冠治疗药物仅有腾盛博药-B(02137.HK)的中和抗体疗法。在研发进度上,截至目前,进入到III期临床研究阶段的国产新冠口服药仅有3款,分别是真实生物的阿兹夫定、君实生物的VV116和开拓药业的普克鲁胺;此外,歌礼药业、先声制药、云顶新耀等药企也有布局,但均处于获批临床或临床前阶段。
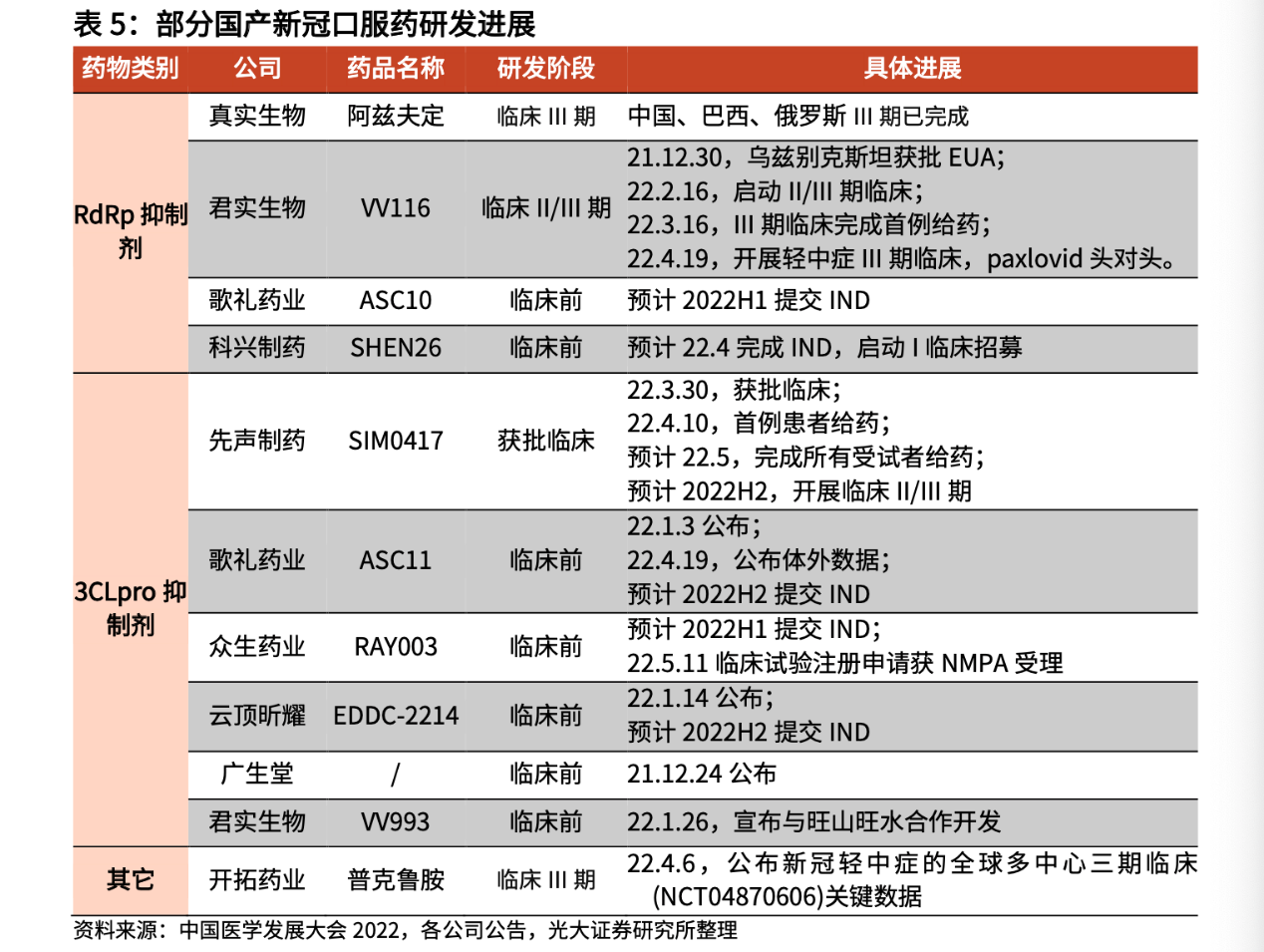
图片来源:研报截图
当前,全球范围内,美国、欧洲市场上已有多款新冠治疗药物获批,包括小分子口服药、中和抗体等不同类型治疗药物,其中辉瑞Paxlovid、默沙东Molnupiravir 等已经取得较为明确的疗效并在全球范围内广泛使用。
国泰君安发布的研报认为,“小分子化药+中和抗体”构建新冠治疗体系,海外中和抗体使用量大,小分子口服药或将成为治疗轻中症患者的主力。
近期,新冠特效药领域不断传出的研发进展及合作动态在资本市场极为“吸睛”,国产新冠口服药已向正式获批发起冲刺,市场上的投资者也都纷纷开始下注,从药物研发企业到上游原料供应商都成为炒作的对象。
4月下旬,新华制药(000756.SZ)公告称,与真实生物签署《战略合作协议》。真实生物同意新华制药为其拥有的阿兹夫定等产品在中国及经双方同意的其他国家的产品生产商和经销商。随后,新华制药股价连续11个交易日涨停。5月8日,华润双鹤也宣布,与真实生物签署《战略合作协议》及《阿兹夫定片委托加工生产框架协议》。华润双鹤将充分利用设备优势和生产条件为新华制药提供良好的产品生产环境,推动真实生物技术成果转化落地。

图片来源:公告截图
5月19日晚间,海正药业(600267.SH)发布公告称,公司与上海旺实生物医药科技有限公司签订了《战略合作协议》及《委托生产框架协议》,双方拟在小分子创新药VV116的产品加工、生产、国际注册、市场开发等领域建立战略合作关系,协议有效期为5年。
公司点评:
就在市场纷纷议论真实生物的阿兹夫定或将成为首款获批的国产新冠口服药时,君实生物的VV116抛出了多项研发和商业化进展,第一款国产新冠口服药最终会“花落谁家”又平添了许多变数。
对于君实生物的投资者来说,一个普遍的担忧是 VV116的研发进展以及公司特瑞普利单抗的生产是否会遭到上海疫情的干扰。对此,《每日经济新闻》记者从君实生物方面了解到,公司的临港生产基地在防疫封控政策开始前安排了一部分员工驻场进行闭环管理,并对生产节奏进行动态调整,维持设备运转、维护不间断。与此同时,君实生物也积极协调公司在上海以外的研发和生产资源,确保在研项目正常推进,保障商业化与临床药品的持续供应。
如需转载请与《每日经济新闻》报社联系。
未经《每日经济新闻》报社授权,严禁转载或镜像,违者必究。
读者热线:4008890008
特别提醒:如果我们使用了您的图片,请作者与本站联系索取稿酬。如您不希望作品出现在本站,可联系我们要求撤下您的作品。
欢迎关注每日经济新闻APP
