每日经济新闻 2021-05-24 20:55:01
◎公开资料显示,截至2020年4月,共有20个药物通过FDA的RTOR项目获得批准,这些药物从申请提交到批准的平均时间为3.3个月,最快0.4个月,最慢5.9个月。
每经记者 金喆 实习生 黄颖琳 每经编辑 汤辉
5月24日,康方生物(09926,HK)发布公告称,康方生物与中国生物制药(01177,HK)共同开发的PD-1单抗派安普利单抗(AK105)已经向美国食品药品监督管理局(FDA)启动提交生物制品许可申请(BLA),寻求上市获批三线治疗转移性鼻咽癌。
《每日经济新闻》记者注意到,派安普利单抗递交的BLA申请,将在FDA加速药物审评的新政策——RTOR(实时肿瘤审评)项目下进行审评。此前,君实生物、信达生物PD-1分别以“滚动申请”、“正常申请”的形式向FDA提交BLA。消息披露后,康方生物在24日开盘后一路拉升,截至收盘,报62.90港元/股,上涨10.25%。
在这3家企业中,谁能获得FDA的第一张批文值得期待,但这只是开始,获批上市后的商业化同样值得关注。有业内人士对记者分析,RTOR被认为是FDA药物审评最快的通道,这三个企业中,只有康方生物的产品还未在国内上市,预计国内PD-1出海后主要靠价格优势竞争。
尽管还未在国内获批,康方生物派安普利单抗的海外研发进展较为顺利。2020年10月,派安普利三线治疗转移性鼻咽癌注册性临床试验达到主要终点,并获FDA授予快速审批通道资格。此次,康方生物则在RTOR项目下进行上市审评。
据了解,加入RTOR计划的药物,相较过去快速审评通道、突破性疗法或者孤儿药等方式,批准所需时间将大大缩短,是FDA药物审评最快的通道。公开资料显示,截至2020年4月,共有20个药物通过FDA的RTOR项目获得批准,这些药物从申请提交到批准的平均时间为3.3个月,最快0.4个月,最慢5.9个月。
康方生物在24日的公告中指出,RTOR是FDA肿瘤学卓越中心颁布的重大创新性肿瘤新药审批新政策,比优先审评速度更快,旨在加快药物审批,尽早及安全有效地用于癌症患者的治疗。公司期待根据RTOR计划提交BLA,可使公司具有差异化的PD-1单抗更快地解决全球鼻咽癌患者的需求。
对此,康方生物相关人士向《每日经济新闻》记者表示,派安普利单抗是中国首个在FDA的RTOR项目下进行BLA的PD-1药物。消息披露后,康方生物-B大涨,截至24日收盘报62.90港元/股,上涨10.25%,创上市以来新高。
对于一家创新药企,市场关注其每一个药物的临床和上市进展。而康方生物的派安普利单抗是其研发管线中最接近商业化的一款产品。
2020年5月,国家药品监督管理局受理派安普利新药上市申请,用于治疗复发或难治性经典型霍奇金淋巴瘤。今年4月下旬,康方生物董事长夏瑜向《每日经济新闻》记者透露,希望PD-1在下半年上市,到目前为止,从派安普利单抗的所有临床数据以及与很多医生的交流反馈来看,安全性较好。
康方生物是第三家向FDA递交PD-1上市申请的国内企业,此前君实生物特瑞普利单抗(用于治疗复发或转移性鼻咽癌)以及信达生物信迪利单抗(治疗一线非鳞非小细胞肺癌),也分别递交上市申请。
今年2月,君实生物(688180,SH)与美国生物药公司Coherus就特瑞普利单抗在美国和加拿大的开发和商业化达成合作。3月3日,君实生物披露公告,已经向FDA提交特瑞普利单抗用于治疗复发或转移性鼻咽癌的BLA。
信达生物(01801,HK)则稍落后于君实生物,成为第二家向FDA提交PD-1上市申请的国产创新药企。5月18日,信达生物公告称,FDA正式受理由信达生物和美国礼来制药合作研发的创新PD-1抑制剂药物达伯舒联合培美曲塞和铂类用于非鳞状非小细胞肺癌(NSCLC)一线治疗的新药上市申请BLA。
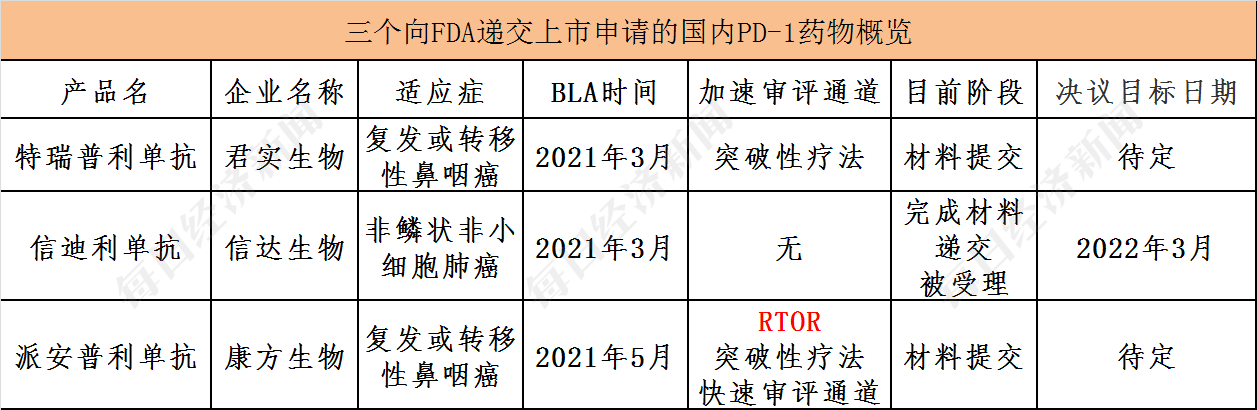
《每日经济新闻》记者注意到,两家公司在申请流程上有所差异,其中君实生物属于“滚动申请”,即药企在申请新药上市许可时,可以将申报文件分批次提交FDA进行审评,而无需等待申报文件全部完成后才向FDA提交申请,此举可缩短新药的审评周期,一般需要约6个月。
信达生物则是“正常申请”,通常需要10个月时间,耗时更长,但因为君实生物目前还没有完成申请,仍然处于滚动中的状态。而信达生物比较明确的一点是,FDA对达伯舒的上市申请做出决议的目标日期是2022年3月。
该业内人士指出,在这场国产PD-1“出海大战”中,FDA首张上市批文何时获得、花落谁家,都是一个未知数。但其实与国内市场一样,考验企业的还是产品上市后的商业化问题。
据了解,目前美国共获批上市了6款PD-1/PD-L1,其中5款PD-1已经在美国获批治疗非小细胞肺癌,美国市场对于该适应症的竞争同样十分激烈,而君实生物和康方生物申请的鼻咽癌属于小癌肿。据世卫组织统计,2020年鼻咽癌的全球新确诊病例数达13.3万,其中半数在中国,海外市场有限。
前述人士对《每日经济新闻》记者坦言,无论最终哪个拿到FDA的首张门票,长远来看中国PD-1在美国上市的意义在于国产创新药能够登上全球舞台,未来还是要布局更多适应症和联合疗法。
封面图片来源:摄图网
如需转载请与《每日经济新闻》报社联系。
未经《每日经济新闻》报社授权,严禁转载或镜像,违者必究。
版权合作及网站合作电话:021-60900099转688
读者热线:4008890008
特别提醒:如果我们使用了您的图片,请作者与本站联系索取稿酬。如您不希望作品出现在本站,可联系我们要求撤下您的作品。
欢迎关注每日经济新闻APP
