每日经济新闻 2020-08-19 16:07:05
8月上半月药物新申报的研发进度有所下降,新冠疫苗研发仍是市场关注的焦点。另外,复宏汉霖首个国产曲妥珠单抗生物类似药获批上市、康方生物双抗药物AK112获批临床也值得关注。
每经记者|金喆 每经编辑|魏官红

丁香园Insight数据库援引国家药品监督管理局药品审评中心数据显示,8月1日~8月15日,共承办318例申报进度,其中受理化药申请247项,生物制品申请58项,中药申请13项。

《每日经济新闻》记者注意到,本阶段药物新申报的研发进度较6月、7月有所下降,新冠疫苗研发仍是市场关注的焦点,在俄罗斯宣布已注册全球首款新冠疫苗后,各国竞相公布疫苗研发最新进度,陈薇院士团队与康希诺生物联合申报的新冠疫苗专利申请也正式获批,成为我国首个新冠疫苗专利。
另外,复宏汉霖首个国产曲妥珠单抗生物类似药获批上市、康方生物双抗药物AK112获批临床,也值得市场关注。
1、新冠疫苗竞赛:俄罗斯先声夺人,我国首个新冠疫苗专利获批
疫苗研发的进度与新冠病毒传播的脚步仍在赛跑,近日,疫苗研发好消息频传。据新华社报道,俄罗斯总统普京8月11日表示,俄卫生部已首次对本国研制的一款新冠疫苗给予国家注册。
8月16日,根据国家知识产权局消息,由国家军科院军事医学研究院陈薇院士团队及康希诺生物联合申报的新冠疫苗专利申请,已被授予专利权。
每经点评:
通常情况下,疫苗研发需8年~10年,成功率仅约20%。公开数据显示,在过去50年,有44个新发现的传染病病原体,但仅有6个疫苗成功开发上市,成功率不足14%。进入21世纪,冠状病毒引起的传染病主要有重症急性呼吸综合征(SARS)、中东呼吸综合征(MERS)以及新型冠状病毒肺炎(COVID-19)。
过去5个月,全球围绕新冠疫苗展开的研究有165个,而在6个进入三期临床试验的疫苗中,有3个由中国研发。

新冠疫苗注册上市本是好消息,俄罗斯发布消息后却引来质疑,主要原因是这款疫苗没有进行三期临床试验,业界对其安全性和有效性有所顾虑。
早期临床试验,一般只能检测出人体是否产生特异性抗体或免疫细胞,并不能真正看出疫苗是否有预防病毒的作用。只有三期临床试验数据明显表明感染率在接种疫苗的人群中出现了降低,疫苗才能获得成功。在香港大学病毒学专家金冬雁看来,三期临床试验是评价疫苗安全性和有效性的关键环节,没有得到三期临床试验结果,很难料定这个疫苗到底是有用还是没用。
“现在没进三期的和已经进入三期的,都可能面临找不到满足条件的受试者的问题。现在中国哪有(那么多)病人?你跑到国外去做,这是史无前例的。”金冬雁对《每日经济新闻》记者指出,三期临床试验对受试者和环境的要求很高,必须是在疫情出现中等暴发的地方找合适的、仍然对病毒易感的受试者,还需要有足够的人数,“得找成千上万个人,所以非常不容易,在哪做都不容易”。
迄今为止,新冠疫苗的研发速度已经创造历史,但医学研究必须谨小慎微。无论资本市场如何“热炒”疫苗概念,新冠疫苗研发关乎人类健康,务必保持一如既往的严格审慎,不应盲目追求时效,而要以安全性和有效性为重。
2、罗氏赫赛汀迎来对手:复宏汉霖曲妥珠单抗上市
8月14日,国家药监局官网显示,复宏汉霖曲妥珠单抗生物类似药获批上市,成为首个国产曲妥珠单抗生物类似药。
每经点评:
这无疑是复宏汉霖寄予厚望的重磅产品之一,是复宏汉霖继汉利康(利妥昔单抗生物类似药)之后国内顺利获批的第二个首仿生物药,也是进入欧洲市场的第一个中国单抗生物类似药。
曲妥珠单抗原研药赫赛汀是罗氏的王牌品种,1998年9月获得美国FDA批准上市后长期占据了药物销售TOP10的名单,但由于专利到期,2018年以后,产品销售额逐渐下滑。2019年全球销售额仅60亿瑞士法郎,同比下滑13.5%。
丁香园Insight显示,国内赫赛汀于2002年获批进口,2016年国内样本医院销售额为7.37亿元,同比增长12.8%。2017年赫赛汀纳入医保后,由原本每瓶21613元降价至7600元,降价幅度达65%,此后国内进入快速放量期。公开数据显示,2019年赫赛汀在中国城市公立医疗机构的销售额约52亿元。
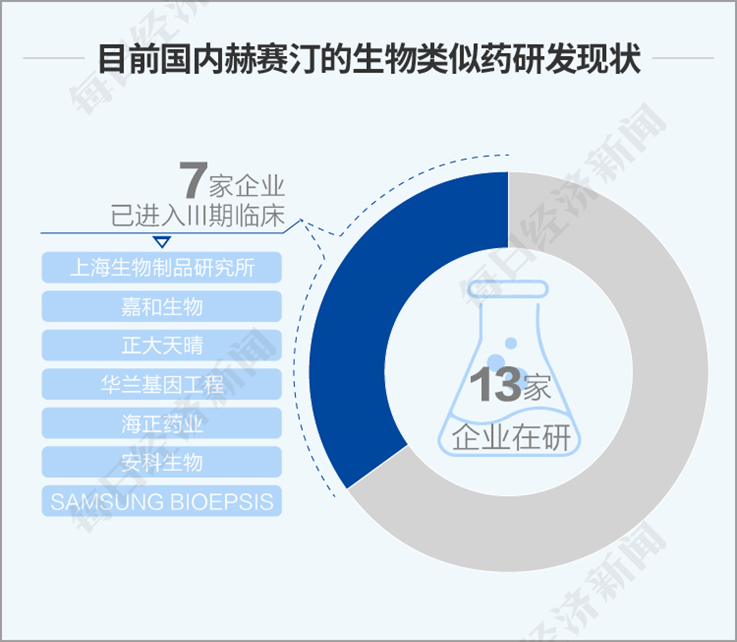
因为专利到期,赫赛汀的生物类似药研发也成为热点。丁香园Insight数据库显示,目前国内还有13家企业在研,有7家企业已经进入三期临床,分别是上海生物制品研究所、嘉和生物、正大天晴、华兰基因工程、海正药业、安科生物、SAMSUNG BIOEPSIS的生物类似药。
不过,《每日经济新闻》记者对比过往很多原研药纳入医保后与仿制药的竞争情况发现,在不考虑价格因素、或价格差距变小后,多数原研药的市场份额难以撼动。因此,对于仿制药企业而言,如何去挑战原研药多年的江山、分得更多市场份额是药物上市后必须思考的大事。
3、康方生物双特异性抗体药物AK112获批临床
8月11日,康方生物发布公告称,其自主研发的双特异性抗体PD-1/VEGF(AK112)获得国家药品监督管理局颁发的药物临床试验批件,将在中国进一步开展针对晚期实体瘤的1b期临床试验。
虽然双抗赛道获批药物较少,但其市场潜力很大。截至2019年年中,全球已有20多种双特异性抗体开发和生产的商业化技术平台。仅国内在研的进入临床试验阶段的PD-(L)1双抗药物便有7款,但仅有康方生物的AK104和康宁杰瑞的KN046进入了二期临床阶段。
AK112是康方生物继双抗PD-1/CTLA-4(AK104)之后第二款全球首创并进入临床开发阶段的双特异性抗体药物,已经于2019年10月在澳洲开展一期临床研究。
4、信达生物PD-1第三个适应症上市获受理,用于一线鳞状非小细胞肺癌
8月12日,信达和礼来制药宣布,国家药监局已经正式受理达伯舒(信迪利单抗注射液)用于鳞状非小细胞肺癌(NSCLC)一线治疗的新适应症申请(sNDA),这是达伯舒在国内申报的第三个适应症。
达伯舒是礼来和信达生物共同开发的创新PD-1抑制剂,于2018年12月24日正式获得国家药监局批准,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤的治疗,第二个适应症联合化疗一线治疗非鳞状非小细胞肺癌(nsqNSCLC)已在今年4月份报上市。
信达生物公布的2020年第二季度销售信息显示,达伯舒第二季度销售收入约为人民币5亿元,一季度实现约4亿元的销售收入;今年上半年,达伯舒累计销售收入达到9亿元。
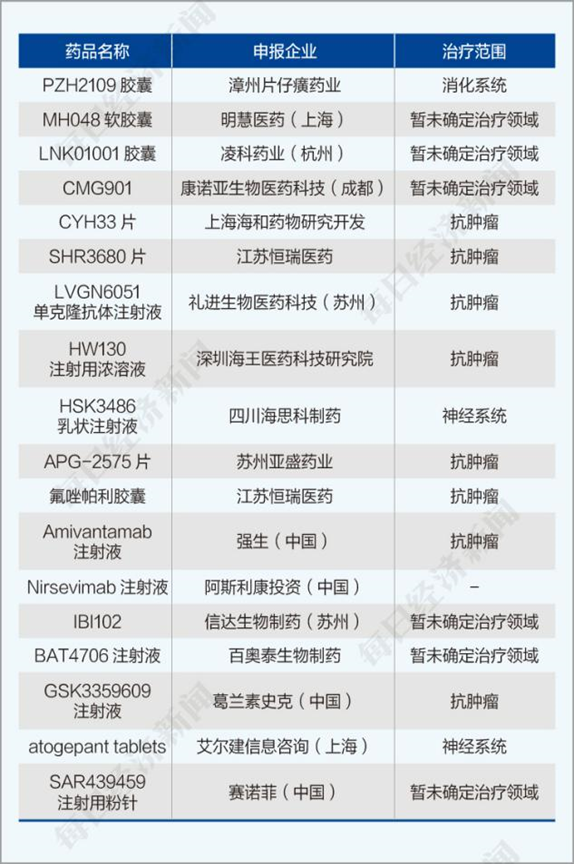
《每日经济新闻》记者统计得知,本阶段没有首次获批的品种上市,化药和生物制品的申报都较7月同期有所降温,一类药物的临床/上市申请数量为18种,占本阶段药品申报数量的5.6%。具体情况如下图所示。
封面图片来源:摄图网
如需转载请与《每日经济新闻》报社联系。
未经《每日经济新闻》报社授权,严禁转载或镜像,违者必究。
读者热线:4008890008
特别提醒:如果我们使用了您的图片,请作者与本站联系索取稿酬。如您不希望作品出现在本站,可联系我们要求撤下您的作品。
欢迎关注每日经济新闻APP
